近日,龙湖现代免疫实验室在非洲猪瘟病毒免疫逃逸机制研究中取得重大进展。团队首次揭示病毒蛋白p22通过劫持宿主自噬系统降解干扰素受体,从而逃避免疫攻击的全新机制,为开发新型非洲猪瘟疫苗和抗病毒药物提供了关键靶点。相关研究成果“The African swine fever virus p22 inhibits the JAK-STAT signaling pathway by promoting the TAX1BP1-mediated degradation of the type I interferon receptor”发表在《PLOS pathogens》(10.1371/journal.ppat.1013319)期刊上(中科院一区,TOP)。

非洲猪瘟病毒是一种高致病性病原体,急性感染死亡率高达100%,这给全球养猪业造成了重大的经济损失,但病毒结构蛋白功能研究存在重大空白。作为非洲猪瘟病毒的关键内膜蛋白,p22在病毒免疫逃逸中的作用长期未知,严重制约了高效疫苗的研发,破解其生物学功能成为迫在眉睫的科学难题。
张改平院士团队联合仇华吉研究员团队在《PLOS Pathogens》发表突破性研究,首次揭示p22蛋白通过其跨膜结构域劫持宿主自噬受体TAX1BP1,特异性介导I型干扰素受体(IFNAR1)的自噬降解,从而阻断JAK-STAT信号通路。该发现不仅阐明p22抑制宿主抗病毒应答的全新分子机制,更意外发现TAX1BP1降解IFNAR1不依赖泛素化通路,改写了对免疫受体调控的认知。
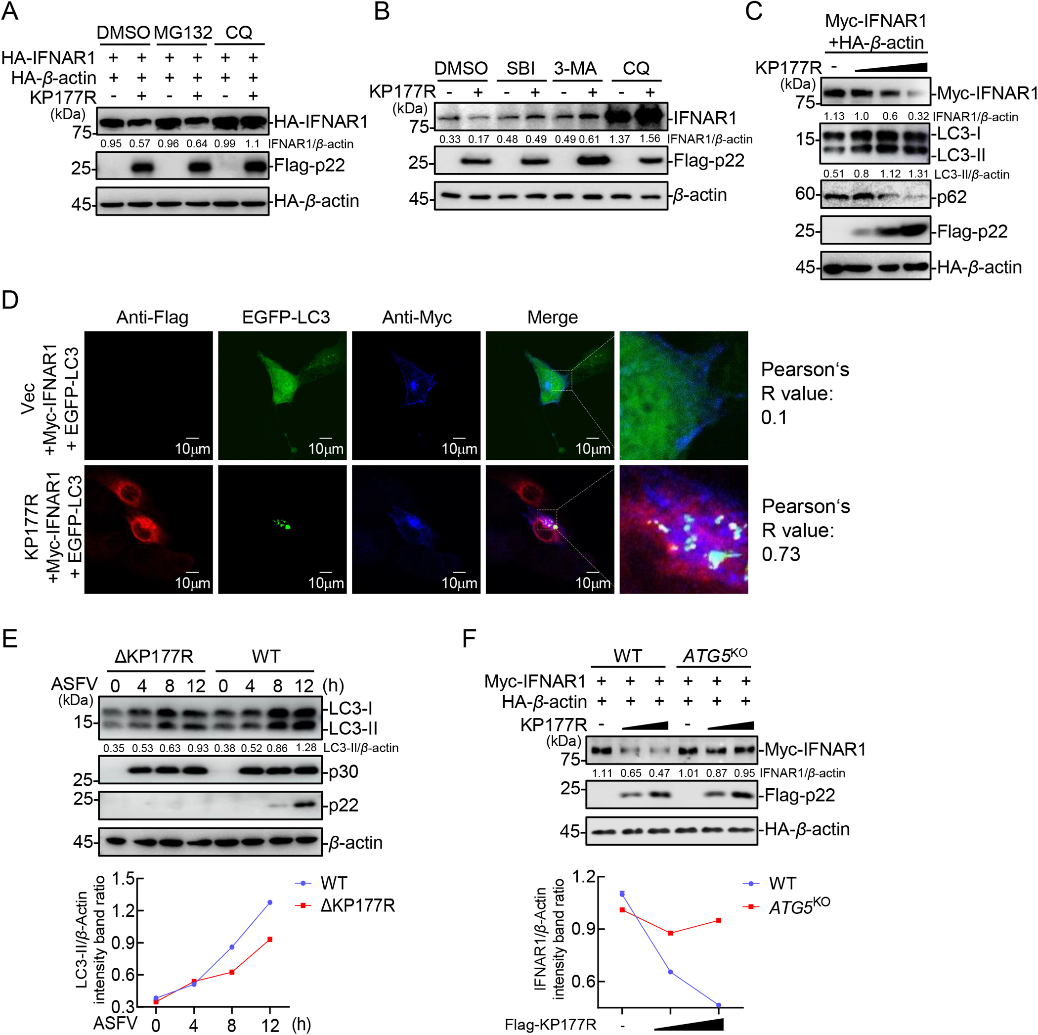
非洲猪瘟病毒p22蛋白通过自噬降解IFNAR1
此项研究从根本上解释了非洲猪瘟病毒逃逸宿主免疫监视的核心策略,为开发靶向p22-TAX1BP1互作界面的新型减毒疫苗和抗病毒药物提供了理论依据,有望突破非洲猪瘟防控的技术瓶颈。
该研究由国家自然科学基金(32102655)和河南省重大科技专项(221100110600)资助。
全文链接: https://doi.org/10.1371/journal.ppat.1013319