近日,龙湖现代免疫实验室和郑州大学科研团队协同攻关,成功设计出一款具备自激活特性的多模块纳米电极(简称 HMPD)。该纳米电极创新性地将谷胱甘肽(GSH)响应性电动力疗法(EDT)与Mn⟡⁺启动的表观遗传重编程相结合,可精准诱导癌细胞发生焦亡,为肿瘤免疫治疗领域提供了全新的突破性策略。相关研究成果(Self-Activatable Multi-Module Nanoelectrode TriggeringElectro-Driven Pyroptosis in Cancer Cells Boost Anti-TumorImmunity)正式发表于国际期刊《Advanced Functional Materials》。该期刊为中科院1区 TOP 期刊,影响因子(IF)高达 18.5,充分彰显了此项研究在国际材料科学与肿瘤治疗交叉领域的重要学术价值。

在肿瘤治疗研究领域,焦亡(Pyroptosis)是一种促炎性细胞的程序性死亡方式,凭借其能够释放肿瘤抗原与细胞因子、进而激活机体免疫系统的独特优势,成为近年来的研究热点。然而,传统焦亡诱导剂在应用中面临两大关键难题:一方面,癌细胞内焦亡关键蛋白 Gasdermin D(GSDMD)的启动子存在甲基化不足的问题,导致焦亡诱导效率受限;另一方面,传统诱导剂缺乏特异性,会对肿瘤微环境中的免疫细胞造成非选择性杀伤,大幅削弱免疫系统的抗肿瘤保护效力,严重制约了其临床应用效果。
此次,龙湖现代免疫实验室与郑州大学团队研发的 HMPD 纳米电极,通过精妙的设计巧妙破解了传统焦亡诱导剂的困境。该研究的核心创新在于将电动力疗法与表观遗传调控技术有机融合,借助纳米电极的智能响应特性,实现了对癌细胞的特异性焦亡诱导。与传统疗法相比,HMPD 纳米电极具备三大显著优势:(1)精准靶向激活:利用肿瘤细胞与正常细胞内谷胱甘肽(GSH)浓度的显著差异,HMPD 可在肿瘤区域特异性激活,有效避免对正常细胞的误伤,极大提升了治疗的安全性。(2)破解焦亡抵抗:通过表观遗传重编程技术,内源性提高癌细胞中 GSDMD 蛋白的表达水平,成功解决了癌细胞对传统焦亡诱导剂的抵抗问题,显著增强了治疗效果。(3)强效免疫激活:HMPD 诱导癌细胞焦亡的过程中,伴随强烈的免疫原性细胞死亡(ICD),会释放大量损伤相关分子模式(DAMPs),如钙网蛋白(CRT)和高迁移率族蛋白 1(HMGB1)等,这些分子能够有效激活机体的抗肿瘤免疫应答,形成“治疗-免疫激活”的良性循环。
从结构设计来看,HMPD 纳米电极采用先进的 “核-壳” 结构,以铂纳米簇(PtNCs)电催化模块为核心,外层包裹由透明质酸修饰的二氧化锰纳米花(HMNFs)为电屏蔽模块,并在中间层嵌入Mn⟡⁺激活的DNAzyme(DDzymes)作为表观遗传重编程模块。在正常细胞和免疫细胞中,因HMNFs的低导电性屏蔽了PtNCs的电催化活性,同时DDzymes处于失活状态;而在癌细胞高浓度GSH环境下,HMNFs可解离并释放Mn⟡⁺和DDzymes,激活电催化产生活性氧(·OH)诱导焦亡,同时通过表观遗传调控上调GSDMD表达,形成协同放大效应(图2)。
深入研究表明,HMPD 纳米电极诱导癌细胞焦亡的工作机制可分为两个紧密衔接的步骤,形成高效的 “双重激活 - 协同杀伤” 模式:首先,癌细胞内高浓度GSH触发HMNFs分解,暴露PtNCs并在交流电作用下催化水生成·OH,引发线粒体氧化应激,激活NLRP3炎症小体和Caspase-1,切割GSDMD形成打孔蛋白(N-GSDMD),导致细胞膜破裂并释放促炎因子。随后,释放的Mn⟡⁺作为辅酶激活DDzymes,特异性切割DNA甲基转移酶1(DNMT1)的mRNA,减少其蛋白表达,从而解除GSDMD启动子的高甲基化抑制,显著提高癌细胞内GSDMD水平,进一步增强焦亡敏感性(图3)。
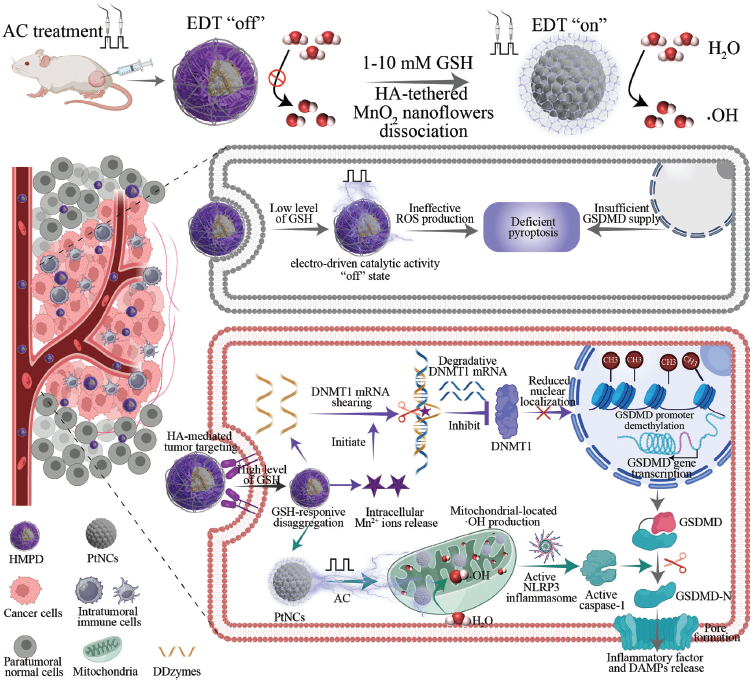
图2 HMPD的结构表征与响应性释放特性
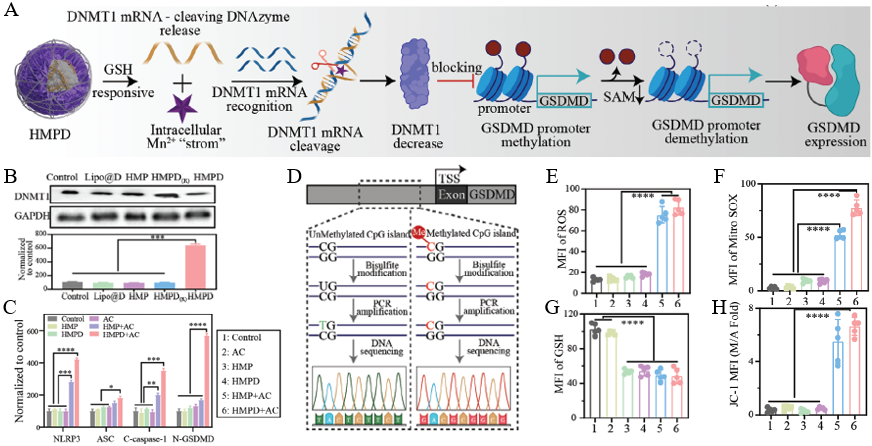
图3 HMPD诱导焦亡的信号通路验证
体外实验显示,HMPD在结直肠癌细胞CT26中可特异性产生活性氧,诱导87.3%的细胞焦亡,释放大量ATP、IL-1β等焦亡标志物,且对正常肝细胞和免疫细胞毒性极低。体内实验中,HMPD联合交流电治疗显著抑制肿瘤生长,肿瘤体积抑制率达73.8%,并激活树突状细胞成熟和CD8⁺T细胞浸润,逆转肿瘤微环境的免疫抑制状态(图4)。
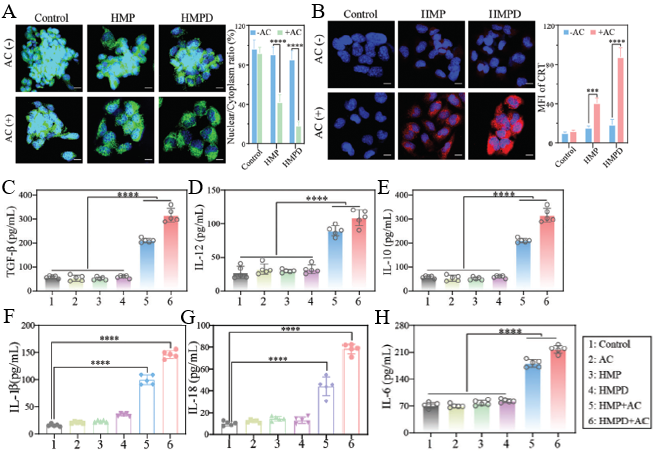
图4 HMPD的体外细胞毒性和焦亡评价
值得关注的是,科研团队还进一步探索了 HMPD 纳米电极与免疫检查点抑制剂(PD-1 抗体)的联合治疗潜力。在双侧肿瘤模型实验中,HMPD 联合 PD-1 抗体治疗方案展现出惊人的协同效应,不仅有效抑制了原发肿瘤的生长,还完全阻止了远端肿瘤的发展,实现了 “局部治疗 - 全身免疫” 的协同抗肿瘤效果,充分彰显了该治疗策略在临床应用中的巨大潜力。
这种 “精准焦亡诱导 + 免疫激活” 的创新治疗策略,为开发高效、低毒的肿瘤治疗方案提供了全新的思路,有望推动电动力疗法与表观遗传药物在癌症治疗领域的深度融合与广泛应用。目前,研究团队正围绕 HMPD 纳米电极的生物相容性优化与体内递送效率提升展开进一步研究,为后续的临床转化工作奠定坚实基础。
此项研究不仅从分子机制层面深化了科研界对焦亡调控的理解,更通过纳米技术与肿瘤免疫学的跨界融合,展示了纳米材料在精准医疗领域的广阔应用前景,为攻克癌症这一全球性重大疾病提供了强有力的科技支撑。
本项目由国家自然科学基金、河南省科技攻关、博士后科学基金和博士后奖学金等项目支持。论文链接:https://advanced.onlinelibrary.wiley.com/ doi/full/10.1002/adfm.202500252